Sel Volta dan Kegunaanya
28 Oktober 2009 pada 08:48 (Kimia)
SEL VOLTA
Sel Volta atau sel galvani adalah sel elektrokimia yang melibatkan raksi redoks dan menghasilkan arus listrik.
Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Susunan sel volta adalah :

Notasi sel : Y / ion Y // ion X / X
Logam X mempunyai potensial reduksi yang lebih positip dibanding logam Y , sehingga logam Y bertindak sebagai anoda dan logam X bertindak sebagai katoda.
Jembatan garam mengandung ion-ion positif dan ion-ion negative yang berfungsi menetralkan muatan positif dan negative dalam larutan elektrolit.
Contoh:
1. Gambarkan rangkaian sel volta yang terdiri atas elektroda magnesium dan seng, jika potensial electrode Mg2+/Mg = – 2,38 volt , Zn2+/ Zn = – 0,76 volt.
Jawab :
Gambar sel Volta elektroda Mg dan Zn

Penjelasan : potensial reduksi logam magnesium lebih negative dari potensial reduksi logam zeng, sehingga logam magnesium bertindak sebagai anoda dan logam seng bertindak sebagai katoda.
Beda potensial Sel dirumuskan :
1. Untuk keadaan standar dengan konsentrasi larutan 1 molar
Eosel = Ekatoda – E anoda
2. Untuk keadaan standar dengan konmsentrasi larutan tidak 1 molar
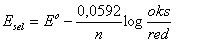
n = jumlah electron
Contoh :
Hitunglah beda potensial sel reaksi redok berikut :
a. Zn / Zn2+ // Ag+ / Ag
b. Zn / Zn2+ 0,2 M // Cu2+ 0,1 M // Cu
Jawab:
a). Gunakan rumus :
Eosel = Ekatoda – E anoda
= + 0,80 – ( – 0,76) = + 1,56 volt
b). Gunakan rumus :

= +0,34 – ( – 0,76 ) + (0,059/2) log 0,2 / 0,1
= + 1,4285 volt
Kegunaan sel Volta
Pada sel volta, reaksi kimia bersifat spontan dan menghasilkan arus listrik. Katode merupakan kutub positif dan anode merupakan kutub negatif. Contoh: penggunaan baterai dan aki. Penemuan bahwa reaksi kimia dapat menghasilkan energi listrik oleh Alessandro Volta (1745-1827) berdasarkan eksperimen Luigi Galvani (1737-1798). Rangkaian alat yang menghasilkan arus listrik dari reaksi kimia selanjutnya disebut sel Volta. Reaksi kimia tersebut hanya terjadi pada reaksi redoks yang berlangsung spontan.
Sel Volta mempunyai elektrode logam yang dicelupkan ke dalam larutan garamnya.

Gambar Sel Volta
Berdasarkan kegunaannya, sel Volta dibedakan atas dua macam sebagai berikut.
a. Sel Volta untuk penentuan pH larutan, energi reaksi, titrasi, kelarutan garam dan sebagainya.
b. Sel Volta untuk menghasilkan tenaga listrik, misalnya untuk penerangan, penggerak motor, radio transistor, dan kalkulator, contoh:
1) Sel Aki
Sel aki dalam keadaan terisi (siap pakai) terdiri atas elektrode Pb (anode) dan PbO2 (katode). Keduanya dicelupkan dalam larutan H2SO4 30%. Jika kedua elektrode telah terlapisi oleh endapan PbSO4 yang terbentuk sebagai hasil reaksi di dalam sel aki, aliran elektron akan terhenti karena terhalang oleh endapan itu. Dikatakan aki telah habis sehingga harus diidi (disetrum). Hal ini dapat dilakukan apabila elektrodenya belum rusak.
2) Sel Kering atau baterai kering (Sel Leclanche)
Baterai kering ditemukan oleh Leclanche yang mendapat hak paten atas penemuan itu pada tahun 1866. Sel Leclanche terdiri atas suatu silinder seng yang berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), karbon (C), dan sedikit air. Seng sebagai anode dan katodenya berupa elektrode inert yaitu grafit yang dicelupkan di tengah-tengah pasta. Pasta berfungsi sebagai oksidator.
3)Baterai Nikel Kadmium
Baterai Nikel Kadmium adalah baterai kering yang dapat diisi kembali. Reaksi sel:
Anode: Cd(s) + 2OH-(aq) –> Cd(OH)2(s) + 2e
Katode: NiO2(s) + 2H2O(l) + 2e –> Ni(OH)2(s) + 2OH-(aq) +
Cd(s) + NiO (s) + 2H2O(l) –>Cd(OH)2(s) + Ni(OH)2(s)
4) Baterai Perak oksida
Baterai perak oksida banyak digunakan sebagai baterai kecil yang banyak digunakan pada arloji, kalkulator, dan berbagai jenis alat elektronik lainnya.
Reaksi elektrodenya:
Anode: Zn(s) + 2OH-(aq) –>Zn(OH)2(s) + 2e
Katode: Ag2O(s) + H2O(l) + 2e –>2Ag(s) + 2OH-(aq)
Sel Volta atau sel galvani adalah sel elektrokimia yang melibatkan raksi redoks dan menghasilkan arus listrik.
Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Susunan sel volta adalah :

Notasi sel : Y / ion Y // ion X / X
Logam X mempunyai potensial reduksi yang lebih positip dibanding logam Y , sehingga logam Y bertindak sebagai anoda dan logam X bertindak sebagai katoda.
Jembatan garam mengandung ion-ion positif dan ion-ion negative yang berfungsi menetralkan muatan positif dan negative dalam larutan elektrolit.
Contoh:
1. Gambarkan rangkaian sel volta yang terdiri atas elektroda magnesium dan seng, jika potensial electrode Mg2+/Mg = – 2,38 volt , Zn2+/ Zn = – 0,76 volt.
Jawab :
Gambar sel Volta elektroda Mg dan Zn

Penjelasan : potensial reduksi logam magnesium lebih negative dari potensial reduksi logam zeng, sehingga logam magnesium bertindak sebagai anoda dan logam seng bertindak sebagai katoda.
Beda potensial Sel dirumuskan :
1. Untuk keadaan standar dengan konsentrasi larutan 1 molar
Eosel = Ekatoda – E anoda
2. Untuk keadaan standar dengan konmsentrasi larutan tidak 1 molar
n = jumlah electron
Contoh :
Hitunglah beda potensial sel reaksi redok berikut :
a. Zn / Zn2+ // Ag+ / Ag
b. Zn / Zn2+ 0,2 M // Cu2+ 0,1 M // Cu
Jawab:
a). Gunakan rumus :
Eosel = Ekatoda – E anoda
= + 0,80 – ( – 0,76) = + 1,56 volt
b). Gunakan rumus :
= +0,34 – ( – 0,76 ) + (0,059/2) log 0,2 / 0,1
= + 1,4285 volt
Kegunaan sel Volta
Pada sel volta, reaksi kimia bersifat spontan dan menghasilkan arus listrik. Katode merupakan kutub positif dan anode merupakan kutub negatif. Contoh: penggunaan baterai dan aki. Penemuan bahwa reaksi kimia dapat menghasilkan energi listrik oleh Alessandro Volta (1745-1827) berdasarkan eksperimen Luigi Galvani (1737-1798). Rangkaian alat yang menghasilkan arus listrik dari reaksi kimia selanjutnya disebut sel Volta. Reaksi kimia tersebut hanya terjadi pada reaksi redoks yang berlangsung spontan.
Sel Volta mempunyai elektrode logam yang dicelupkan ke dalam larutan garamnya.

Gambar Sel Volta
Berdasarkan kegunaannya, sel Volta dibedakan atas dua macam sebagai berikut.
a. Sel Volta untuk penentuan pH larutan, energi reaksi, titrasi, kelarutan garam dan sebagainya.
b. Sel Volta untuk menghasilkan tenaga listrik, misalnya untuk penerangan, penggerak motor, radio transistor, dan kalkulator, contoh:
1) Sel Aki
Sel aki dalam keadaan terisi (siap pakai) terdiri atas elektrode Pb (anode) dan PbO2 (katode). Keduanya dicelupkan dalam larutan H2SO4 30%. Jika kedua elektrode telah terlapisi oleh endapan PbSO4 yang terbentuk sebagai hasil reaksi di dalam sel aki, aliran elektron akan terhenti karena terhalang oleh endapan itu. Dikatakan aki telah habis sehingga harus diidi (disetrum). Hal ini dapat dilakukan apabila elektrodenya belum rusak.
2) Sel Kering atau baterai kering (Sel Leclanche)
Baterai kering ditemukan oleh Leclanche yang mendapat hak paten atas penemuan itu pada tahun 1866. Sel Leclanche terdiri atas suatu silinder seng yang berisi pasta dari campuran batu kawi (MnO2), salmiak (NH4Cl), karbon (C), dan sedikit air. Seng sebagai anode dan katodenya berupa elektrode inert yaitu grafit yang dicelupkan di tengah-tengah pasta. Pasta berfungsi sebagai oksidator.
3)Baterai Nikel Kadmium
Baterai Nikel Kadmium adalah baterai kering yang dapat diisi kembali. Reaksi sel:
Anode: Cd(s) + 2OH-(aq) –> Cd(OH)2(s) + 2e
Katode: NiO2(s) + 2H2O(l) + 2e –> Ni(OH)2(s) + 2OH-(aq) +
Cd(s) + NiO (s) + 2H2O(l) –>Cd(OH)2(s) + Ni(OH)2(s)
4) Baterai Perak oksida
Baterai perak oksida banyak digunakan sebagai baterai kecil yang banyak digunakan pada arloji, kalkulator, dan berbagai jenis alat elektronik lainnya.
Reaksi elektrodenya:
Anode: Zn(s) + 2OH-(aq) –>Zn(OH)2(s) + 2e
Katode: Ag2O(s) + H2O(l) + 2e –>2Ag(s) + 2OH-(aq)


